Уважаемые одиннадцатиклассники!
5 апреля 2018 года вам предстоит написать Всероссийскую проверочную работу по химии.
Документы и образцы работ здесь.
На этой страничке вы найдете помощь по подготовке к работе. Ключевые видео отмечены значком: "смотреть обязательно!!!"
В качестве основы использована официальная демоверсия работы - 2018.
Задание 1. Чистые вещества и смеси. Научные методы познания веществ и химических явлений.
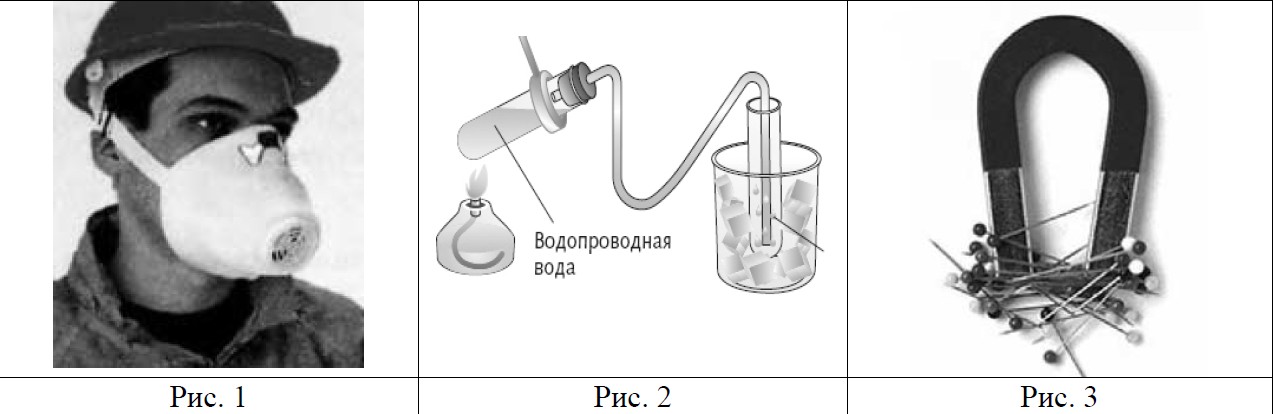
Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
Запишите в таблицу способы, которыми можно разделить данные смеси, и номера рисунков, их иллюстрирующие.
|
Смесь |
№ рисунка |
Способ разделения смеси |
|
Cтальные кнопки и древесные опилки |
|
|
|
Воздух и распыленные мелкие капли водоэмульсионной краски |
|
|
Комментарии. Дистилляция - это выпаривание + конденсация. Так, например, получают дистиллированную воду, очищая ее от растворенных в ней нелетучих веществ. Или разделяют нефть на отдельные фракции.
Кристаллизацией, например, очищают йод (при нагревании он переходит в газообразное состояние (возгоняется), а попадая в холодную зону, образует кристаллы) или поваренную соль (рассол помещается в бассейн, при естественном испарении воды происходит кристаллизация соли).
Задание 2. Состав атома: протоны, нейтроны, электроны. Строение электронных оболочек атомов.
На основе схемы распределения электронов по энергетическим уровням определите:
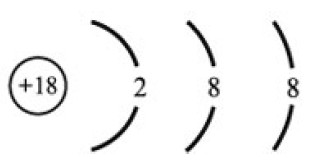
Какой это элемент?
В каком периоде он находится?
В какой группе он стоит?
Металл это или неметалл?
Комментарии. Здесь помним, что:
№ элемента = количеству протонов в ядре = количеству электронов.
№ периода = количеству электронных уровней.
№ группы = количеству электронов на внешнем уровне.
Количество нейтронов = массовое число - № элемента.
У металлов большой радиус и мало электронов на внешнем уровне (1-3), у неметаллов – маленький радиус и много электронов на внешнем уровне.
Задание 3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
Известно, что с увеличением порядкового номера в периодах радиусы атомов уменьшаются, а в группах – увеличиваются. Расположите элементы: N, Al, C, Si в порядке уменьшения их радиусов атомов.
Комментарии. Подсказки содержатся в вопросе. Просто читайте его внимательно. В периодах - это слева направо, в группах - сверху вниз.
Подробнее все про закономерности системы - в ролике: ссылка.
Задание 4. Виды химической связи. Вещества молекулярного и немолекулярного строения. Типы кристаллических решёток.
В таблице перечислены свойства веществ с атомной и молекулярной кристаллической решеткой. На основе этих данных определите тип решетки кварца SiO2 и углекислого газа CO2
|
Молекулярная решетка |
Атомная решетка |
|
В обычных условиях твердые, жидкие или газообразные; Низкие температуры кипения и плавления; Летучие; Имеют низкую теплопроводность |
Твердые в обычных условиях; Хрупкие; Тугоплавкие; Нелетучие |
Комментарии. Про виды связи помним, что ионная связь образуется между атомами металла и неметалла, ковалентная – между неметаллами (неполярная связывает одинаковые атомы, полярная – разные).
Подробнее про все типы решеток - в ролике: ссылка.
Задание 5. Классификация и номенклатура неорганических соединений.
Оксид серы(IV) используют в пищевой промышленности в качестве консерванта (Е220), поскольку этот газ убивает микроорганизмы, им окуривают овощехранилища и склады, а также используют для отбеливания соломы, шелка, шерсти, то есть материалов, которые нельзя отбеливать хлором. Промышленный способ получения этого вещества заключается в сжигании серы или сульфидов. В лабораторных условиях его получают воздействием сильных кислот на сульфиты, например взаимодействием серной кислоты с сульфитом натрия. При взаимодействии оксида серы(IV) с гидроксидом кальция образуется соль сульфит кальция. Это вещество применяется в пищевой промышленности как пищевая добавка Е226 – консервант, для приготовления желе, мармелада, мороженого, напитков.
Впишите в схему классификации по одной формуле для каждого класса веществ.
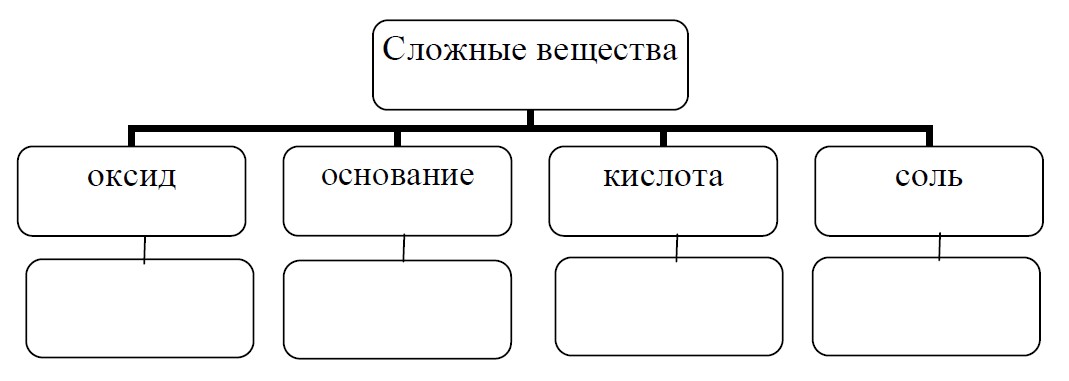
Комментарии.
Классы веществ - ролик: ссылка Смотреть обязательно!!!
Составление формул солей - ролик: ссылка Смотреть обязательно!!!
Задание 6. Характерные химические свойства простых веществ – металлов и неметаллов. Характерные химические свойства оксидов.
Составьте молекулярное уравнение реакции сжигания серы, о котором говорилось в тексте. Укажите, с каким тепловым эффектом протекает эта реакция (происходит выделение или поглощение теплоты).
Комментарии. Видео об уравнениях химических реакций: ссылка. Смотреть обязательно!!!
Задание 7. Характерные химические свойства оснований, амфотерных гидроксидов, кислот, солей.
Составьте уравнение упомянутой реакции между оксидом серы(IV) и гидроксидом кальция. Опишите признаки протекания реакции между оксидом серы(IV) и раствором гидроксида кальция.
Комментарии. Поможет ролик из задания 6. Признаки реакций, из которых можно выбирать: образование осадка (смотрим таблицу растворимости, осадок - это образовавшееся нерастворимое вещество), выделение газа, изменение цвета, появление запаха.
Задание 8. Электролитическая диссоциация. Сильные и слабые электролиты. Реакции ионного обмена. Среда водных растворов электролитов.
При исследовании минерализации бутилированной воды в ней обнаружили ионы Ag+, Na+, Mg2+. Для проведения качественного анализа к этой воде добавили CaCl2. Какие изменения можно наблюдать в растворе? Составьте сокращенное ионное уравнение реакции.
Комментарии. Видео об ионных уравнениях реакций: ссылка.
Задание 9. Окислительно-восстановительные реакции
Дана схема окислительно-восстановительной реакции :
HNO3 + Cu → Cu(NO3)2 + NO2 + H2O. Составьте электронный баланс, укажите окислитель и восстановитель, расставьте коэффициенты.
Комментарии. Водеоролик о расстановке степеней окисления: ссылка
Видеоролик об окислительно-восстановительных реакциях: ссылка
Задание 10. Взаимосвязь основных классов неорганических веществ
Na2S --> H2S --> SO2 --> BaSO3
Напишите уравнения реакций для следующих превращений/
Комментарии. Видеоролик из задания 6!
Для заданий 11-13 используйте формулы следующих веществ:
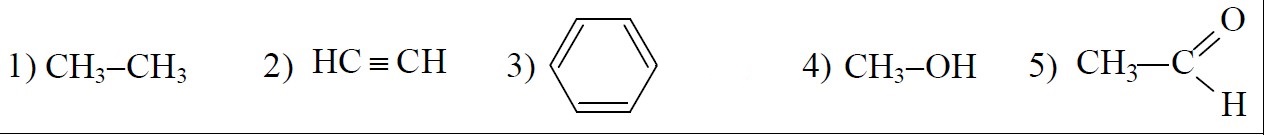
Задание 11. Классификация и номенклатура органических соединений. Теория строения органических соединений. Гомологический ряд, гомологи. Структурная изомерия. Виды химических связей в молекулах органических соединений.
Выберите среди этих веществ и запишите в таблицу
|
Предельный углеводород |
Одноатомный спирт |
|
|
|
Комментарии. Видеоролик: классификация углеводородов: ссылка.
Задание 12. Характерные химические свойства: алканов, алкенов, алкадиенов, алкинов, аренов; кислородсодержащих соединений: одно- и многоатомные спирты, фенол, альдегиды, одноосновные карбоновые кислоты, сложные эфиры, жиры, углеводы; азотсодержащих соединений: аминов, аминокислот, белков.
Вставьте формулы пропущенных веществ:
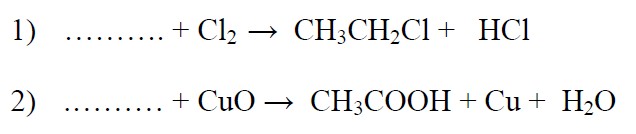
Комментарии. Объем материала большой. Поэтому посмотреть только об уравнениях реакций в органической химии: ссылка.
Задание 13. Взаимосвязь между основными классами органических веществ.
Толуол является сырьем для производства топлива с высоким октановым числом. Его получают по схеме:
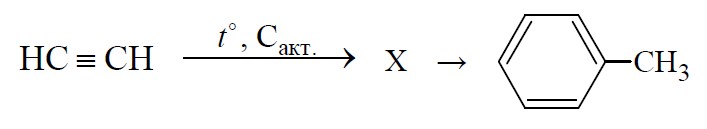
Какое вещество является веществом Х? Напишите название этого вещества. Запишите уравнения реакций.
Комментарии. Видео к заданию 12.
Задание 14. Проведение расчётов количества вещества, массы или объёма по количеству вещества, массе или объёму одного из реагентов или продуктов реакции. Природные источники углеводородов: нефть и природный газ. Предельно- допустимая концентрация вещества.
Одним из важных понятий в экологии является предельно допустимая концентрация (ПДК). ПДК – это такая концентрация вредного вещества, которая не оказывает неблагоприятного воздействия, находясь в окружающей среде в течение всей жизни индивида. ПДК формальдегида составляет 0,003 мг/м3. В помещении площадью 40 м2 с высотой потолка 2,5 м, с поверхности дверей, изготовленных из древесно-стружечной плиты и пропитанных формальдегидом, испарилось 1,2 мг формальдегида. Определите, превышена ли ПДК. Предложите способ, позволяющий снизить концентрацию формальдегида в помещении.
Комментарии. В данной задаче расчеты по уравнению реакции не нужны. Просто примените знание математики.
Как делать расчеты по уравнению - в ролике: ссылка.
Задание 15. Расчеты с использованием понятия «массовая доля вещества в растворе».
Для обработки обожженных кожных покровов применяют 5%-ный раствор перманганата калия. Рассчитайте массы перманганата калия и воды, которые необходимы для приготовления 120 г такого раствора. Запишите подробное решение этой задачи.
Комментарии. Расчеты чисто математические. Или вспомните "метод стаканчиков".

